Справочник по рефрактометрам
Измерение смазочно-охлаждающей жидкости (СОЖ), очищающего раствора и гидравлической жидкости (промышленные водные растворы)
При измерении концентрации различных водных растворов, таких как водорастворимая СОЖ, чистящий раствор, ингибитор коррозии, гидравлическая жидкость, этиловый спирт, раствор перекиси водорода, глицерин, антифриз и гидроксид натрия, с помощью рефрактометра (или бриксметра[1]) используется метод градуировочного графика (графика преобразования), связывающий показания прибора по шкале Брикс (или показателя преломления) и концентрацию. Градуировочный график готовится заранее.
Построение градуировочного графика
❶ Чтобы построить градуировочный график, приготовьте водные растворы водорастворимой СОЖ с концентрациями 5%, 10% и 15%. При этом используйте поверенные средства измерения и чистые растворители (воду). Производите смешивание с соблюдением соответствующей методики.
При количественной оценке концентрации растворов может использоваться любая из перечисленных мер[2]: массовая доля, ω (г/ 100 г), массовая концентрация, С (г/100 мл) или объемная доля, φ (мл/100 мл).
Массовая доля ω компонента раствора, выраженная в процентах, показывает, сколько г данного компонента содержится в 100 г раствора. Раствор с массовой концентрацией Спредставляет собой количество растворяемого вещества, выраженное в г, на 100 мл раствора. Объемная доля φ определяется через отношение объемов растворяемого вещества и раствора, выраженные, как правило, в мл.
Для корректного построения градуировочного графика используйте одну и ту же оценочную меру (величину) для всех точек графика.
Примеры
Для приготовления раствора с массовой долей 10,0% возьмите 10,0 г неразбавленной смазочно-охлаждающей жидкости и 90,0 г воды, массы которых были измерены с помощью весов.
Для приготовления раствора с объемной долей 10,0% раствор состоит из 10,0 мл неразбавленной смазочно-охлаждающей жидкости и 90,0 мл воды, измеренных с помощью градуированного цилиндра.
❷ Перед процедурой измерений ОБЯЗАТЕЛЬНО проверьте чистоту измерительной ячейки прибора и выполните установку нуля по дистиллированной воде.
❸ Выполните измерение параметров (показатель преломления или значение концентрации по шкале Брикс) приготовленных 5%, 10% и 15%-ных растворов с помощью рефрактометра (бриксметра) в ручном режиме, записывая данные измерений.
❹ Пример полученных данных для произвольного вещества приведен в Таблице 1.
Таблица 1.
Концентрация раствора | Показания прибора (Brix) |
| 0.0%[3] | 0.0% |
| 5.0% | 3.5% |
| 10.0% | 7.1% |
| 15.0% | 10.5% |
❺ На основе этих данных постройте градуировочный график вида, изображенного на Рисунке 1.
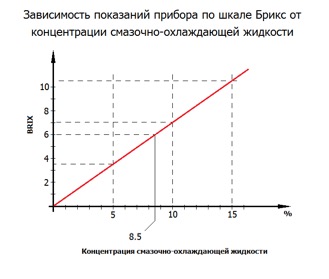
Теперь неизвестные значения концентраций для данного вещества могут быть найдены с использованием измеренных на рефрактометре (бриксметре) значений. Например, если измеренное на рефрактометре значение равно 6,0% по шкале Брикс, то с помощью приведенного выше градуировочного графика можно определить, что истинное значение концентрации составляет 8,5%.
Помимо зависимости показателя преломления (Брикс) от концентрации, с использованием аналогичного метода могут быть построены другие зависимости (графики функций), например:
- зависимость значений показателя преломления (Брикс) от удельного веса для водных растворов,
- зависимость значений показателя преломления (Брикс) от соотношения компонентов в двухкомпонентных нефтяных жидкостях,
- зависимость показателя преломления (Брикс) от концентрации загрязнения для случаев, когда при механической обработке масло или флюс растворяются в чистящем растворе,
и другие зависимости.
При построении градуировочного графика следует учитывать наличие температурной зависимости показателя преломления, которая количественно выражается с помощью физической величины «температурный коэффициент» :
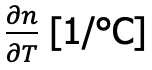
Температурный коэффициент показывает, насколько изменяется показатель преломления измеряемого вещества при изменении температуры на 1°C. Большинство веществ имеют отрицательный температурный коэффициент, то есть с повышением температуры показатель преломления вещества уменьшается. Как правило, температурный коэффициент имеет постоянную величину лишь в определенном диапазоне температур. Общий характер зависимости показателя преломления от температуры является нелинейным.
Для корректных измерений концентраций (особенно это актуально для органических и нефтяных жидкостей), следует использовать модели рефрактометров, имеющих возможность автоматического поддержания температуры на элементах Пельтье (например, модели автоматических цифровых рефрактометров серии RX), либо стационарные Аббе-рефрактометры (серии NAR, DR), имеющие возможность подключения циркуляционной водяной бани 60-С5 или другого внешнего термостата.
Иными словами значения для градуировочного графика должны быть получены при постоянной температуре, и точность метода тем больше, чем ближе температура последующих измерений к температуре, при которой был построен градуировочный график.
* Значения из Таблицы 1 могут быть использованы для построения графика с помощью электронных таблиц Excel, в которых может быть получена аппроксимированная прямая (или кривая) и ее уравнение, что позволяет создать более подробную и точную таблицу преобразования. Если точки получаемой зависимости располагаются не на прямой (нелинейная зависимость), уравнение кривой может быть также создано с помощью специальных программ-утилит, например, таких как CurveExpert.
** При использовании бриксметра (рефрактометра) на месте (в полевых условиях) построить градуировочный график (Рис.1) затруднительно, при этом зачастую пользователя интересует узкий диапазон допустимых значений. Поэтому просто определяют и запоминают значение допуска, выраженное в Брикс, что равнозначно определению некоторого критерия качества в относительных единицах.
[1] Неофициальное название рефрактометра, заводские настройки которого позволяют пользователю видеть результаты измерений только по шкале Брикс.
[2] Меры концентрации, используемые в России. В отраслях химической промышленности, а также в фармацевтике встречаются молярная (мольная) концентрация, титр, моляльность и другие меры.
[3] Значение для дистиллированной воды
